Sarcopenie heeft een belangrijke impact op het dagelijkse leven en de levenskwaliteit van veel ouderen. Door de toenemende vergrijzing en verzilvering van onze samenleving is preventie en vroegtijdige detectie van sarcopenie cruciaal om erger te voorkomen. De huisarts maar ook thuishulp en andere zorgverleners kunnen hierin een belangrijke rol vervullen. Qua voeding en beweging moet men korter en concreter op de bal spelen.
BEKNOPT
-
Sarcopenie staat voor leeftijdsgebonden verlies van spiermassa en spierfunctie (spierkracht en fysiek functioneren). Het heeft een belangrijke impact op de kwaliteit van leven van ouderen en is sterk geassocieerd met fragiliteit.
-
Sarcopenie is een aandoening die nog onvoldoende gekend is bij het brede publiek en nog al te vaak aan de aandacht ontsnapt. Het treft nochtans tot 29% van de thuiswonende ouderen en tot 33% van de ouderen in woonzorgcentra.
-
Verschillende factoren spelen een rol in de ontwikkeling van sarcopenie: toenemende leeftijd, een sedentaire leefstijl, een lagere socio-economische status, roken, malnutritie en ongezonde voedingsgewoonten.
-
Voldoende beweging en vooral weerstandstraining staan centraal in de preventie en de behandeling van sarcopenie.
- Samen met beweging zijn ook verschillende voedingsinterventies aangewezen, waaronder vooral een optimalisatie van de inname van eiwitten en van vitamine D om tekorten tegen te gaan.
In Vlaanderen zal de veroudering van de bevolking zich de komende 10 jaar blijven verderzetten. Naar schatting zal het aantal Vlaamse 65- tot 79-jarigen tussen 2016 en 2030 met 37% toenemen (vergrijzing) en het aantal 80-jarigen met 43% (verzilvering) (1). Deze trend brengt verschillende uitdagingen met zich mee. Terwijl de ene persoon gezond veroudert, doet de andere dat niet. Verouderen doen we zowel fysiek als mentaal. Daarnaast kunnen psychosociale en cognitieve problemen fysieke achteruitgang in de hand werken en omgekeerd (bv. sociale isolatie, sedentaire levensstijl). Spiermassa en spierfunctie hebben een belangrijke invloed op het fysieke functioneren en op het behoud van de zelfredzaamheid van ouderen (2). Levensstijlaanpassingen zoals gezonde voeding en voldoende beweging spelen een cruciale rol om deze spiermassa en -functie te bewaren (3).
Sarcopenie
Sarcopenie of leeftijdsgebonden verlies van spiermassa en spierfunctie (spierkracht en fysiek functioneren) is een belangrijk onderdeel van het verouderingsproces (4). Het treft tot 29% van de thuiswonende ouderen en tot 33% van de ouderen in woonzorgcentra (3). Sarcopenie verhoogt het risico op functionele beperkingen, gangstoornissen, vallen, breuken, hospitalisatie en vroegtijdig overlijden en heeft dus een aanzienlijke impact op de kwaliteit van leven van ouderen (5-7). Als gevolg van sarcopenie zijn ongeveer 20% van de vrouwen en 10% van de mannen ouder dan 65 jaar niet in staat om te hurken of een gewicht van 4,5 kg op te heffen. Dat belemmert alledaagse activiteiten zoals iets oprapen en boodschappen doen (2). Sarcopenie is ook sterk geassocieerd met fragiliteit en wordt zelfs vaak beschouwd als het biologische substraat van fysieke fragiliteit (8,9). Fragiliteit staat voor een toestand van ouderdomsgebonden fysiologische kwetsbaarheid die voortkomt uit een verstoorde homeostatische reserve en een verminderde weerbaarheid tegen problemen. Gezien de belangrijke impact van sarcopenie op het leven van oudere personen is preventie en vroegtijdige detectie met behandeling aangewezen.
‘Time is muscle’
Idealiter wordt op jonge leeftijd voldoende spiermassa en spierkracht opgebouwd om een zo hoog mogelijke piek te bereiken (figuur 1). Op volwassen leeftijd moet deze piek zo goed mogelijk worden bewaard en onderhouden. Ongezonde leefstijlfactoren waaronder een sedentaire leefstijl werken verlies van spiermassa en spierkracht in de hand, terwijl een gezonde, sportieve leefstijl dit juist afremt. Leefstijlfactoren op zich zorgen al voor aanzienlijke interindividuele verschillen in spiermassa en spierkracht doorheen de levensloop (figuur 1). Op oudere leeftijd komt het erop aan om het spierverlies te beperken (10).
Vanaf de leeftijd van 50 jaar daalt de spiermassa à rato van 1 tot 2% per jaar. De spierkracht daalt tussen de leeftijd van 50 en 60 jaar met een snelheid van 1,5% per jaar en versnelt na de leeftijd van 60 jaar tot 3% per jaar (11). Zodra de kritische drempel van lage spiermassa en lage spierkracht wordt bereikt, is er sprake van sarcopenie.
Figuur 1: Spiermassa- en krachtevolutie gedurende de levensloop.
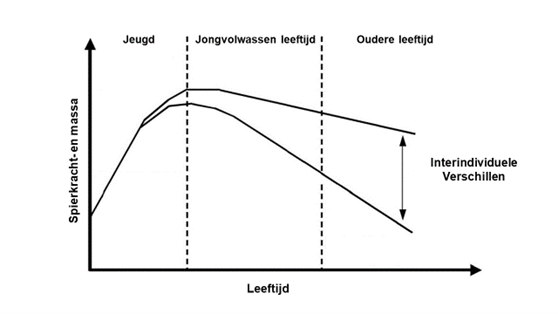
Bewerkt en vertaald met toestemming van SpringerNature (10)
Diagnose
In de klinische praktijk wordt de diagnose van sarcopenie gesteld op basis van metingen van de spierkracht, bijvoorbeeld door een stoeltest (de tijd die nodig is om zo snel mogelijk 5 keer op te staan van een stoel en weer te gaan zitten) of een meting van de handgrijpkracht. Daarnaast wordt spiermassa bepaald door middel van DXA (Dual-energy X-ray Absorptiometry) of BIA (Bioelektrische Impedantie-Analyse). Ten slotte wordt er een inschatting gemaakt van het fysieke functioneren, bijvoorbeeld door de wandelsnelheid te meten, een SPPB (Short Physical Performance Battery) te laten uitvoeren of een 6-minuten-wandeltest af te nemen (4).
Volgens de meest recente definitie van de ‘European Working Group on Sarcopenia in Older People’ (EWGSOP2) is de diagnose van sarcopenie waarschijnlijk zodra de spierkracht verlaagd blijkt (4). De diagnose wordt bevestigd wanneer dit bovendien gepaard gaat met een verlaagde spiermassa. Als het fysieke functioneren ten slotte eveneens is afgenomen, spreekt men van ernstige sarcopenie (4). In de klinische praktijk volstaat een verminderde spierkracht als indicatie om een behandeling op te starten.
Risicofactoren
Verschillende factoren spelen een rol in de ontwikkeling van sarcopenie. Toenemende leeftijd - onder meer gepaard gaand met veranderde hormoonspiegels, chronische laaggradige inflammatie en meer oxidatieve stress - en een sedentaire leefstijl zijn de belangrijkste risicofactoren (9). Daarnaast spelen ook een lagere socio-economische status en roken mee (12,13). De rol van malnutritie en ongezonde voedingsgewoonten (bv. onvoldoende eiwitinname en een weinig gevarieerde voeding) mag evenmin worden onderschat (13). Het betreft hier niet enkel gevallen van ondervoeding en sterk gewichtsverlies. Sarcopenie kan ook voorkomen bij personen met een normaal gewicht of overgewicht met weinig spiermassa en te veel vetmassa. Het is belangrijk om te letten op de lichaamssamenstelling, niet enkel op het lichaamsgewicht. Ten slotte kan sarcopenie eveneens worden bevorderd door metabole veranderingen ten gevolge van verschillende chronische aandoeningen zoals chronische hartlijden, obesitas en diabetes.
Spiermetabolisme en veroudering
Spierweefsel is een dynamisch orgaan. Het lichaam zoekt continu een evenwicht tussen spieraanmaak en spierafbraak. Spieraanmaak wordt gestimuleerd door anabole stimuli, zoals eiwitrijke maaltijden, insuline en beweging. Zij zorgen voor een activatie van de spiereiwitsynthese.
Het effect van anabole stimuli verandert echter met veroudering: eenzelfde hoeveelheid eiwitten heeft bij jonge personen een sterker anabool effect dan bij ouderen (14-16). Ouderen hebben daarom nood aan een hogere eiwitinname om spieraanmaak te stimuleren. Ditzelfde principe geldt ook voor het effect van beweging: een gelijke inspanning heeft een beperkter anabool effect op oudere leeftijd dan op jongere leeftijd (16). Dit fenomeen is bekend onder de noemer anabole resistentie (14).
Bij jonge personen is de spieraanmaak en -afbraak in balans zolang de voeding voldoende eiwitten aanbrengt. Bij sarcopene ouderen is de spiereiwitsynthese uit balans en vindt er meer spierafbraak plaats. Verschillende factoren kunnen bijdragen aan deze ontregeling. Anabole resistentie en insulineresistentie spelen een belangrijke rol, maar ook chronische laaggradige inflammatie, die optreedt bij veroudering (zogenaamde ‘inflammaging’) en chronische aandoeningen, stimuleren de spierafbraak (17). Ten slotte bevordert ook oxidatieve stress leeftijdsgebonden verlies van spiermassa en -functie (18). De huidige behandelingsstrategieën trachten in te spelen op deze pathofysiologie door anabole resistentie te overwinnen en chronische laaggradige inflammatie te bestrijden.
Preventie en behandeling
Voorkomen is beter dan genezen. De meerderheid van de behandelingen van sarcopenie kunnen ook worden gebruikt als preventiestrategieën. Beweging staat centraal in de behandeling en preventie van sarcopenie (19). Daarnaast zijn ook verschillende voedingsinterventies mogelijk (zie verder). Diverse medicamenteuze behandelingen zoals het gebruik van ontstekingsremmers (NSAID’s), ACE-inhibitoren en plantenextracten werden onderzocht, maar zijn voorlopig onvoldoende wetenschappelijk onderbouwd om ze algemeen toe te passen (20,21). Bij mannen kan een testosteronsubstitutie helpen tegen sarcopenie – testosteron is belangrijk voor spiergroei en -herstel - maar gezien de potentiële nevenwerkingen (bv. virilisatie, trombose, prostaatcarcinoom) wordt dit voor deze indicatie in de praktijk zelden gebruikt (22,23).
Beweging
Lichaamsbeweging is belangrijk bij gezond verouderen (meer info over de bewegingsdriehoek: www.gezondleven.be/themas/beweging-sedentair-gedrag).
Ter preventie en behandeling van sarcopenie zijn verschillende soorten training mogelijk. Progressieve weerstandstraining is het best bestudeerd en gevalideerd bij sarcopenie en wordt het meest aangeraden (3). Hierbij gebruikt men gewichten als weerstand. Deze weerstand wordt gradueel verhoogd tijdens het trainingsschema. Bij aanvang van de training bepaalt men de ‘1 repetitie maximum’ (1RM). De 1RM is het maximale gewicht dat een persoon in een specifieke oefening met één herhaling kan tillen en waarbij de oefening technisch volledig juist wordt uitgevoerd. Op basis van de 1RM-bepaling schrijft het trainingsschema vervolgens oefeningen voor aan 60-90% van deze 1RM om maximale anabole stimulatie van de spieren te bekomen (16). Door een dergelijke gecontroleerde lichte overbelasting ontstaan microlaesies, die de spiereiwitsynthese stimuleren (24). Tijdens het trainingsschema wordt de 1RM best regelmatig opnieuw bepaald en de belasting aangepast. Idealiter wordt drie keer per week getraind, telkens afgewisseld met een rustdag om voldoende herstel te garanderen.
Naast weerstandstraining is ook evenwichtstraining nuttig in het kader van valpreventie (25). Ten slotte kan er ook een uithoudingstraining (cardio) worden ingebouwd via bijvoorbeeld wandelen, lopen of fietsen (24).
In de praktijk is het aangewezen om sarcopene ouderen te stimuleren om voldoende te bewegen en om een gecombineerd trainingsprogramma op te starten onder begeleiding van een kinesist (meer info: www.valpreventie.be).
Voldoende eiwitten
De eiwitinname is vaak suboptimaal bij ouderen. Door anabole resistentie hebben ouderen bovendien een hogere eiwitbehoefte dan jongere personen. De inname is bij ouderen vaak beperkt door onder meer een verminderde eetlust, kauw- en slikstoornissen en smaakverlies.
De aanbevolen eiwitinname voor jongvolwassenen is 0,8 g per kg lichaamsgewicht (LG) per dag (d). Voor gezonde ouderen is dit 1 tot 1,2 g/kg LG/d en voor ouderen met acute of chronische aandoeningen, zoals fragiele en sarcopene ouderen, wordt zelfs een inname van 1,2 tot 1,5 g/kg LG/d aanbevolen (26,27). Voor een persoon van 60 kg komt dit laatste overeen met 72 tot 90 g eiwitten per dag. Hierbij moet echter rekening worden gehouden met de nierfunctie. Bij een klaring van minder dan 30 ml/min/1,73m² zonder dialyse is een eiwitinname hoger dan 0,8 g/kg LG/d niet aan te raden. Dialysepatiënten hebben wel baat bij een hogere eiwitinname (meer dan 1,2 g/kg LG/d) aangezien er tijdens de dialyse eiwitverlies optreedt (26).
Om de spiereiwitsynthese te optimaliseren wordt de inname best gespreid over verschillende maaltijden en niet geconcentreerd in één maaltijd. Er wordt gestreefd naar 25-30 g eiwitten per maaltijd, waarvan 2,5-2,8 g leucine (meer info over eiwitten: infografiek ‘Eiwitten in de voeding’) (26).
Aandacht voor de eiwitkwaliteit
De eiwitkwaliteit – bepaald door de aminozuursamenstelling en de verteerbaarheid - vraagt eveneens aandacht. Essentiële aminozuren – zij kunnen niet door het lichaam zelf worden aangemaakt - stimuleren de spiereiwitsynthese. Het essentiële aminozuur leucine speelt een prominente rol in de behandeling van sarcopenie omwille van haar unieke anabole eigenschappen. Het is enerzijds een essentieel aminozuur en bevordert anderzijds de intracellulaire signaalcascade die verantwoordelijk is voor de spiereiwitsynthese (28-30).
Dierlijke eiwitbronnen (melkproducten, ei, vlees, vis) hebben een goede aminozuursamenstelling en worden efficiënt verteerd. Plantaardige eiwitbronnen zijn onder meer tofu en peulvruchten zoals linzen, bonen en kikkererwten (71). Omdat de eiwitkwaliteit van plantaardige voedingsmiddelen lager is, is er meer van nodig om hetzelfde effect op spiergroei te krijgen. Leucine is vooral aanwezig in dierlijke voedingsmiddelen en in het bijzonder als onderdeel van melkwei-eiwitten, maar ook in soja (tofu) en peulvruchten.
Eiwitinname optimaliseren
Sarcopene ouderen moeten hun eiwitinname optimaliseren, zowel qua kwantiteit als kwaliteit. Zeker bij het ontbijt en de lunch is 25 tot 30 g eiwitten binnenkrijgen niet evident. Wanneer het streefdoel niet haalbaar is via de dagelijkse voeding, moet een eiwitsupplement of een verrijkte voeding worden opgestart. Een adequate eiwitinname moet ten slotte samengaan met een adequate energie-inname. Zo niet wordt een deel van de eiwitten als energiebron gebruikt in plaats van als bouwstof.
Gezonde mix van eiwitten en beweging
De spiereiwitsynthese wordt maximaal gestimuleerd door de combinatie van een adequate eiwitinname en beweging (26,28).
Wanneer eiwitten worden ingenomen omstreeks een beweegmoment, kan de beweging de spiereiwitsynthese verder versterken (31). Anderzijds maakt beweging, zowel weerstands- als uithoudingstraining, het lichaam gevoeliger voor eiwitten als stimulus van de spiereiwitsynthese (32). Dit synergistische effect is maximaal ongeveer 60 minuten na de beweging, maar de verhoogde sensitiviteit voor anabole stimuli, die door beweging wordt uitgelokt, kan tot 24 uur aanhouden (33). Ter preventie en behandeling van sarcopenie is het gebruik van zuivelproducten of eiwitsupplementen die leucine bevatten hierbij ideaal.
Ouderen stimuleren om meer lichaamsbeweging te nemen rond de maaltijden (bv. een blokje om wandelen of oefeningen inplannen na de maaltijd) kan dus op een eenvoudige manier bijdragen aan de preventie en de behandeling van sarcopenie.
Vitamine D
Vitamine D is goed gekend voor zijn rol in de behandeling van osteoporose, maar het is ook van belang in de aanpak van sarcopenie (34). Onderzoek heeft aangetoond dat vitamine D-deficiëntie geassocieerd is met spierzwakte, een verhoogd valrisico en een verminderd fysiek functioneren (35).
Tot 40% van de thuiswonende ouderen kampt met een tekort aan vitamine D. Dit is vooral te wijten aan een verminderde blootstelling aan de zon doordat men minder buiten komt en door de beperkte aanwezigheid van vitamine D in de voeding (vooral in smeer- en bereidingsvetten, volle melkproducten, eigeel en vette vis) (36,37). Een eierdooier bijvoorbeeld bevat echter maar 22 IU vitamine D, terwijl 800-1000 IU vitamine D per dag aangewezen is om het evenwicht en de spierkracht te verbeteren (38). Eerder onderzoek heeft aangetoond dat vitamine D-suppletie een positief effect heeft op spierkracht (39). Het effect van een vitamine D-supplement op de spiermassa is nog omstreden en vergt meer onderzoek. Waar een eerdere studie een gunstig effect op de spiermassa detecteerde, kon een recente studie geen effect op spiereiwitsynthese weerhouden (40,73). Daarnaast zou vitamine D-suppletie ook bijdragen tot minder valrisico (41).
In de praktijk is een vitamine D-supplement dus aanbevolen bij ouderen met een tekort aan vitamine D of een verhoogd valrisico (42,43).
Omega 3-vetzuren
Omega 3-vetzuren kunnen een rol spelen in het behoud van spierkracht en -massa door hun anti-inflammatoire en anabole eigenschappen (44,45). Een klassiek westers voedingspatroon brengt vooral het omega 3-vetzuur alfa-linoleenzuur (ALA) aan dat aanwezig is in onder meer bepaalde plantaardige oliën, noten en chiazaad (46). Vette vis (bv. zalm en makreel) is een belangrijke bron van de omega 3-vetzuren eicosapentaeenzuur (EPA) en docosahexaeenzuur (DHA).
Een hogere inname van omega 3-vetzuren en van EPA en DHA in het bijzonder, lijkt geassocieerd met bepaalde gezondheidsvoordelen, waaronder een verbeterde handgrijpkracht en wandelsnelheid (47,48). Dit heeft geleid tot de opzet van verschillende interventiestudies die hebben bevestigd dat een omega 3-suppletie de wandelsnelheid en de spiermassa bij gezonde ouderen bevordert (49-51). Enkele studies suggereren bovendien dat een omega 3-suppletie gecombineerd met beweging of een trainingsprogramma het effect van beweging op de spierkracht en -massa verder versterkt (52,53). Voorlopig ontbreekt dergelijk onderzoek nog bij sarcopene ouderen en is er vandaag onvoldoende wetenschappelijke evidentie om omega 3-supplementen systematisch op te nemen in de behandeling van sarcopenie. Tevens speelt de vraag of een omega 3-suppletie op zich voldoende zou zijn bij sarcopene ouderen en of het niet zou moeten worden gecombineerd met eiwitten en/of beweging omwille van synergistische effecten. Er is dus nood aan grotere prospectieve studies met omega 3-supplementen bij deze doelgroep om de exacte dosering, frequentie en rol in de behandeling van sarcopenie te kunnen bepalen. Intussen kan er al wel op een adequate inname via de voeding worden toegekeken.
Calcium
Calcium speelt een belangrijke rol in de cascade voor spieractivatie en -contractie (45,54). Er is intracellulair calcium nodig om de spier te laten contraheren en kracht te genereren. Daarnaast speelt calcium een rol in de werking van calpaïnes, eiwitten die bijdragen aan de spierregeneratie (55). De wetenschappelijke literatuur is echter nog tegenstrijdig over de associatie tussen de calciuminname en sarcopenie. Sommige studies vonden een positieve associatie met een verminderde prevalentie van sarcopenie (56,57). Andere konden deze link niet bevestigen (58,59). Indien een patiënt reeds een calciumsupplement neemt (al dan niet in combinatie met vitamine D) in het kader van bijvoorbeeld de preventie of de behandeling van osteoporose, is er geen reden om dit niet verder te zetten omwille van sarcopenie. De opstart van calciumsupplementen bij de indicatie sarcopenie wordt voorlopig echter nog niet geadviseerd. Wanneer er geen supplementen zijn voorgeschreven blijft toezicht op een adequate calciuminname via de voeding sowieso belangrijk voor iedereen, ook voor alle ouderen.
Vitaminen B12 en B6
Een vitamine B12-deficiëntie gaat gepaard met neuromusculaire symptomen zoals spierzwakte en paresthesieën (45,60). Een recente Nederlandse studie vond een gunstig verband tussen een verhoogde inname van vitamine B12 en spierkracht (61). Eerder onderzoek had ook al een toegenomen prevalentie van sarcopenie vastgesteld bij personen met verlaagde vitamine B12-waarden (62).
Een ernstig tekort aan vitamine B6 kan eveneens leiden tot neurologische symptomen en spierzwakte (45). Vitamine B6 blijkt gunstig gecorreleerd met spierkracht en fysiek functioneren (61). Een lagere inname van vitamine B6 is geassocieerd met een verhoogd risico op fragiliteit (63).
Er zijn aanwijzingen dat vitamine B12 en B6 een protectieve rol kunnen spelen in de ontwikkeling van sarcopenie, maar voorlopig is er onvoldoende evidentie om systematische suppletie aan te bevelen zolang er hiervan geen tekorten zijn vastgesteld.
Vitamine C
Oxidatieve stress draagt bij tot de ontwikkeling van sarcopenie. Vitamine C wordt beschouwd als een belangrijk antioxidans en kan dus in theorie een rol spelen bij de behandeling van sarcopenie (45). Vroeger onderzoek heeft aangetoond dat de inname van vitamine C via de voeding positief is geassocieerd met fysiek functioneren en spierkracht (64). Uit later onderzoek bij jonge mannen die hoge dosissen van een antioxidantsupplement kregen (vitamine C+E) bleek echter dat de toename van spiermassa door een trainingsprogramma net afzwakte wanneer dit gecombineerd werd met het supplement (65).
De exacte rol van vitamine C bij sarcopenie blijft dus onduidelijk.
Veganisme: meer risico op tekorten
Veganisten schrappen zoals vegetariërs vlees uit hun voeding, maar daarnaast ook vis, eieren en melk en melkproducten. Een veganistische voeding riskeert makkelijker te weinig eiwitten en/of essentiële aminozuren, calcium, omega 3-vetzuren (EPA en DHA) en vitamine B12 aan te brengen (66,67). Voor optimaal spierbehoud moet men beducht zijn voor mogelijke tekorten van deze macro- en micronutriënten.
Bij sarcopene ouderen wordt gestreefd naar een inname van 1,2 tot 1,5 g eiwitten/kg LG/d (26). Omdat plantaardige eiwitbronnen een lagere biologische waarde hebben en minder vlot verteerbaar zijn, wordt de eiwitbehoefte van veganisten bovendien 1,3 maal hoger ingeschat dan van mensen met een gemengde voeding (72). Voor een sarcopene oudere van 60 kg die veganistisch eet betekent dat 94 tot 117 g eiwitten per dag in plaats van 72 tot 90 g per dag voor een sarcopene oudere van 60 kg met een gemengde voeding. In een strikt veganistische voeding is het eveneens belangrijk maar dus nog minder evident om de aanbevolen eiwitinname te vrijwaren. Gezien zijn anabole eigenschappen is het bovendien belangrijk om ook voldoende leucine in de voeding te voorzien. Bij het gebruik van voedingsmiddelen die meer eiwitten bevatten met een hogere eiwitkwaliteit volstaat een kleinere hoeveelheid voedsel om aan de noden te kunnen voldoen, zeker ook bij ouderen die kleine eters zijn. Bij een ernstig tekort is het aangewezen om suppletie te voorzien in de vorm van plantaardige eiwitsupplementen, bijvoorbeeld op basis van soja.
Qua omega 3-vetzuren nemen veganisten voornamelijk ALA in (vooral aanwezig in bepaalde oliën, noten, groene groenten en peulvruchten) en krijgen ze maar weinig EPA en DHA (vooral aanwezig in vette vis) binnen in vergelijking met omnivoren (68). Het lichaam kan slechts in beperkte mate ALA converteren in EPA, maar amper in DHA (69). Een supplement van EPA en DHA nemen op basis van microalgen in plaats van op basis van visolie behoort tot de mogelijkheden om de aanbevolen dagelijkse inname te halen (70).
Aangezien dierlijke producten onze belangrijkste natuurlijke bronnen zijn van vitamine B12 (vooral vlees en eieren) en calcium (vooral melk en melkproducten) moeten mogelijke tekorten actief worden opgespoord en gecorrigeerd, voor het behoud van de algemene gezondheid maar ook omwille hun potentieel gunstige rol tegen de ontwikkeling van sarcopenie.
Meer lezen over de impact van de zuivelmatrix op de musculoskeletale gezondheid:
Impact of whole dairy matrix on musculoskeletal health and aging – current knowledge and research gaps - Geiker NRW et al. Osteoporosis Int 2020; 31(4) :601-615
‘Consensus statement’ naar aanleiding van een expertenworkshop, georganiseerd onder auspiciën van de ‘European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases’ (ESCEO).
Kernboodschappen
- Niet alleen osteoporose maar ook sarcopenie komt steeds vaker voor. Beide aandoeningen lijken intergerelateerd (muscle-bone-cross-talk) en verhogen het risico op vallen en botfracturen.
- Bewijs uit interventiestudies en observationeel onderzoek laat zien dat melk en melkproducten, en in het bijzonder ook gefermenteerde zuivel, gunstige effecten hebben op de musculoskeletale gezondheid in alle levensfasen, ook op latere leeftijd.
- Deze effecten kunnen niet volledig worden verklaard op basis van de aanwezigheid van bepaalde voedingsstoffen in zuivel (o.m. calcium, eiwitten, vitamine D). Dat kan wijzen op een gecombineerd effect of matrixeffect. De specifieke natuurlijke fysico-chemische structuur van zuivel (bv. caseïnemicellen, het melkvetglobulemembraan) lijkt van invloed op de vertering, de absorptie en de biobeschikbaarheid van voedingsstoffen en op het uiteindelijke effect van melk, yoghurt en kaas. Bij andere voedingsmiddelen kunnen andere productspecifieke factoren, zoals de vorm waarin voedingsstoffen aanwezig zijn, van invloed zijn.
- De gezondheidseffecten en een mogelijk matrixeffect van alle voedingsmiddelen (dierlijke, plantaardige, al lang bestaande en nieuwe producten), niet enkel van hun nutriënten, moeten verder worden onderzocht in goed opgezette studies.
- Voedingspatronen veranderen, waaronder ook het gebruik van meer plantaardige voedingsmiddelen. De nutritionele kwaliteit en de gezondheidseffecten van aangepaste voedingspatronen moeten worden opgevolgd en verder onderzocht, zowel op korte als lange termijn (bv. het effect van de voedingsgewoonten op jongere leeftijd – vandaag nog vaak ondermaats, zeker ook bij adolescenten - op bijvoorbeeld het fractuurrisico op latere leeftijd).
Meer info
- Gezond eten > Per leeftijd > Voeding bij 50-plussers
- Materialen > Infografieken > Eiwitten in de voeding
- Nutrinews 2017 nr. 4 > Ondervoeding bij ouderen voorkomen
1. Vergrijzing en verzilvering in de Vlaamse steden en gemeenten.: Vlaamse Overheid; 2016 [Available from: https://www.vlaanderen.be/publicaties/vergrijzing-en-verzilvering-in-de-vlaamse-steden-en-gemeenten.
2. McLeod M, Breen L, Hamilton DL, Philp A. Live strong and prosper: the importance of skeletal muscle strength for healthy ageing. Biogerontology. 2016;17(3):497-510.
3. Cruz-Jentoft AJ, Landi F, Schneider SM, Zuniga C, Arai H, Boirie Y, Chen LK, Fielding RA, Martin FC, Michel JP, Sieber C, Stout JR, Studenski SA, Vellas B, Woo J, Zamboni M, Cederholm T. Prevalence of and interventions for sarcopenia in ageing adults: a systematic review. Report of the International Sarcopenia Initiative (EWGSOP and IWGS). Age Ageing. 2014;43(6):748-59.
4. Cruz-Jentoft AJ, Bahat G, Bauer J, Boirie Y, Bruyere O, Cederholm T, Cooper C, Landi F, Rolland Y, Sayer AA, Schneider SM, Sieber CC, Topinkova E, Vandewoude M, Visser M, Zamboni M. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019;48(1):16-31.
5. Schaap LA, van Schoor NM, Lips P, Visser M. Associations of Sarcopenia Definitions, and Their Components, With the Incidence of Recurrent Falling and Fractures: The Longitudinal Aging Study Amsterdam. The journals of gerontology Series A, Biological sciences and medical sciences. 2018;73(9):1199-204.
6. Zhang X, Zhang W, Wang C, Tao W, Dou Q, Yang Y. Sarcopenia as a predictor of hospitalization among older people: a systematic review and meta-analysis. BMC geriatrics. 2018;18(1):188.
7. De Buyser SL, Petrovic M, Taes YE, Toye KR, Kaufman JM, Lapauw B, Goemaere S. Validation of the FNIH sarcopenia criteria and SOF frailty index as predictors of long-term mortality in ambulatory older men. Age Ageing. 2016;45(5):602-8.
8. Fried LP, Tangen CM, Walston J, Newman AB, Hirsch C, Gottdiener J, Seeman T, Tracy R, Kop WJ, Burke G, McBurnie MA. Frailty in older adults: evidence for a phenotype. The journals of gerontology Series A, Biological sciences and medical sciences. 2001;56(3):M146-56.
9. Cruz-Jentoft AJ, Sayer AA. Sarcopenia. Lancet (London, England). 2019;393(10191):2636-46.
10. Sayer AA, Syddall H, Martin H, Patel H, Baylis D, Cooper C. The developmental origins of sarcopenia. The journal of nutrition, health & aging. 2008;12(7):427-32.
11. von Haehling S, Morley JE, Anker SD. An overview of sarcopenia: facts and numbers on prevalence and clinical impact. Journal of cachexia, sarcopenia and muscle. 2010;1(2):129-33.
12. Steffl M, Bohannon RW, Petr M, Kohlikova E, Holmerova I. Relation between cigarette smoking and sarcopenia: meta-analysis. Physiological research. 2015;64(3):419-26.
13. Dennison EM, Sayer AA, Cooper C. Epidemiology of sarcopenia and insight into possible therapeutic targets. Nature reviews Rheumatology. 2017;13(6):340-7.
14. Cuthbertson D, Smith K, Babraj J, Leese G, Waddell T, Atherton P, Wackerhage H, Taylor PM, Rennie MJ. Anabolic signaling deficits underlie amino acid resistance of wasting, aging muscle. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 2005;19(3):422-4.
15. Burd NA, Gorissen SH, van Loon LJ. Anabolic resistance of muscle protein synthesis with aging. Exercise and sport sciences reviews. 2013;41(3):169-73.
16. Kumar V, Selby A, Rankin D, Patel R, Atherton P, Hildebrandt W, Williams J, Smith K, Seynnes O, Hiscock N, Rennie MJ. Age-related differences in the dose-response relationship of muscle protein synthesis to resistance exercise in young and old men. J Physiol. 2009;587(1):211-7.
17. Dalle S, Rossmeislova L, Koppo K. The Role of Inflammation in Age-Related Sarcopenia. Front Physiol. 2017;8:1045.
18. Thoma A, Akter-Miah T, Reade RL, Lightfoot AP. Targeting reactive oxygen species (ROS) to combat the age-related loss of muscle mass and function. Biogerontology. 2020.
19. Steffl M, Bohannon RW, Sontakova L, Tufano JJ, Shiells K, Holmerova I. Relationship between sarcopenia and physical activity in older people: a systematic review and meta-analysis. Clinical interventions in aging. 2017;12:835-45.
20. Alturki M, Beyer I, Mets T, Bautmans I. Impact of drugs with anti-inflammatory effects on skeletal muscle and inflammation: A systematic literature review. Experimental gerontology. 2018;114:33-49.
21. Beyer I, Bautmans I, Njemini R, Demanet C, Bergmann P, Mets T. Effects on muscle performance of NSAID treatment with piroxicam versus placebo in geriatric patients with acute infection-induced inflammation. A double blind randomized controlled trial. BMC musculoskeletal disorders. 2011;12:292.
22. De Spiegeleer A, Beckwée D, Bautmans I, Petrovic M. Pharmacological Interventions to Improve Muscle Mass, Muscle Strength and Physical Performance in Older People: An Umbrella Review of Systematic Reviews and Meta-analyses. Drugs & aging. 2018;35(8):719-34.
23. De Spiegeleer A, Petrovic M, Boeckxstaens P, Van Den Noortgate N. Treating sarcopenia in clinical practice: where are we now? Acta clinica Belgica. 2016;71(4):197-205.
24. Marzetti E, Calvani R, Tosato M, Cesari M, Di Bari M, Cherubini A, Broccatelli M, Savera G, D'Elia M, Pahor M, Bernabei R, Landi F. Physical activity and exercise as countermeasures to physical frailty and sarcopenia. Aging clinical and experimental research. 2017;29(1):35-42.
25. Robertson MC, Campbell AJ, Gardner MM, Devlin N. Preventing injuries in older people by preventing falls: a meta-analysis of individual-level data. Journal of the American Geriatrics Society. 2002;50(5):905-11.
26. Bauer J, Biolo G, Cederholm T, Cesari M, Cruz-Jentoft AJ, Morley JE, Phillips S, Sieber C, Stehle P, Teta D, Visvanathan R, Volpi E, Boirie Y. Evidence-based recommendations for optimal dietary protein intake in older people: a position paper from the PROT-AGE Study Group. Journal of the American Medical Directors Association. 2013;14(8):542-59.
27. Volkert D, Beck AM, Cederholm T, Cruz-Jentoft A, Goisser S, Hooper L, Kiesswetter E, Maggio M, Raynaud-Simon A, Sieber CC, Sobotka L, van Asselt D, Wirth R, Bischoff SC. ESPEN guideline on clinical nutrition and hydration in geriatrics. Clin Nutr. 2019;38(1):10-47.
28. Gielen E, Beckwée D, Delaere A, De Breucker S, Vandewoude M, Bautmans I. Nutritional interventions to improve muscle mass, muscle strength, and physical performance in older people: an umbrella review of systematic reviews and meta-analyses. Nutrition reviews. 2020.
29. Jackman SR, Witard OC, Philp A, Wallis GA, Baar K, Tipton KD. Branched-Chain Amino Acid Ingestion Stimulates Muscle Myofibrillar Protein Synthesis following Resistance Exercise in Humans. Front Physiol. 2017;8:390.
30. Katsanos CS, Kobayashi H, Sheffield-Moore M, Aarsland A, Wolfe RR. A high proportion of leucine is required for optimal stimulation of the rate of muscle protein synthesis by essential amino acids in the elderly. American journal of physiology Endocrinology and metabolism. 2006;291(2):E381-7.
31. Breen L, Phillips SM. Skeletal muscle protein metabolism in the elderly: Interventions to counteract the 'anabolic resistance' of ageing. Nutrition & metabolism. 2011;8:68.
32. Dideriksen K, Reitelseder S, Holm L. Influence of amino acids, dietary protein, and physical activity on muscle mass development in humans. Nutrients. 2013;5(3):852-76.
33. Burd NA, West DW, Moore DR, Atherton PJ, Staples AW, Prior T, Tang JE, Rennie MJ, Baker SK, Phillips SM. Enhanced amino acid sensitivity of myofibrillar protein synthesis persists for up to 24 h after resistance exercise in young men. The Journal of nutrition. 2011;141(4):568-73.
34. Tessier AJ, Chevalier S. An Update on Protein, Leucine, Omega-3 Fatty Acids, and Vitamin D in the Prevention and Treatment of Sarcopenia and Functional Decline. Nutrients. 2018;10(8).
35. Holick MF. Vitamin D deficiency. The New England journal of medicine. 2007;357(3):266-81.
36. Holick MF. Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease. Am J Clin Nutr. 2004;80(6 Suppl):1678s-88s.
37. Chapuy MC, Schott AM, Garnero P, Hans D, Delmas PD, Meunier PJ. Healthy elderly French women living at home have secondary hyperparathyroidism and high bone turnover in winter. EPIDOS Study Group. The Journal of clinical endocrinology and metabolism. 1996;81(3):1129-33.
38. Muir SW, Montero-Odasso M. Effect of vitamin D supplementation on muscle strength, gait and balance in older adults: a systematic review and meta-analysis. Journal of the American Geriatrics Society. 2011;59(12):2291-300.
39. Beaudart C, Buckinx F, Rabenda V, Gillain S, Cavalier E, Slomian J, Petermans J, Reginster JY, Bruyère O. The effects of vitamin D on skeletal muscle strength, muscle mass, and muscle power: a systematic review and meta-analysis of randomized controlled trials. The Journal of clinical endocrinology and metabolism. 2014;99(11):4336-45.
40. El Hajj C, Fares S, Chardigny JM, Boirie Y, Walrand S. Vitamin D supplementation and muscle strength in pre-sarcopenic elderly Lebanese people: a randomized controlled trial. Archives of osteoporosis. 2018;14(1):4.
41. Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB, Orav JE, Stuck AE, Theiler R, Wong JB, Egli A, Kiel DP, Henschkowski J. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ (Clinical research ed). 2009;339:b3692.
42. Summary of the Updated American Geriatrics Society/British Geriatrics Society clinical practice guideline for prevention of falls in older persons. Journal of the American Geriatrics Society. 2011;59(1):148-57.
43. Morley JE, Argiles JM, Evans WJ, Bhasin S, Cella D, Deutz NE, Doehner W, Fearon KC, Ferrucci L, Hellerstein MK, Kalantar-Zadeh K, Lochs H, MacDonald N, Mulligan K, Muscaritoli M, Ponikowski P, Posthauer ME, Rossi Fanelli F, Schambelan M, Schols AM, Schuster MW, Anker SD. Nutritional recommendations for the management of sarcopenia. Journal of the American Medical Directors Association. 2010;11(6):391-6.
44. Dupont J, Dedeyne L, Dalle S, Koppo K, Gielen E. The role of omega-3 in the prevention and treatment of sarcopenia. Aging clinical and experimental research. 2019.
45. Ganapathy A, Nieves JW. Nutrition and Sarcopenia-What Do We Know? Nutrients. 2020;12(6).
46. Vannice G, Rasmussen H. Position of the academy of nutrition and dietetics: dietary fatty acids for healthy adults. Journal of the Academy of Nutrition and Dietetics. 2014;114(1):136-53.
47. Robinson SM, Jameson KA, Batelaan SF, Martin HJ, Syddall HE, Dennison EM, Cooper C, Sayer AA. Diet and its relationship with grip strength in community-dwelling older men and women: the Hertfordshire cohort study. Journal of the American Geriatrics Society. 2008;56(1):84-90.
48. Frison E, Boirie Y, Peuchant E, Tabue-Teguo M, Barberger-Gateau P, Feart C. Plasma fatty acid biomarkers are associated with gait speed in community-dwelling older adults: The Three-City-Bordeaux study. Clin Nutr. 2017;36(2):416-22.
49. Smith GI, Atherton P, Reeds DN, Mohammed BS, Rankin D, Rennie MJ, Mittendorfer B. Dietary omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: a randomized controlled trial. Am J Clin Nutr. 2011;93(2):402-12.
50. Smith GI, Julliand S, Reeds DN, Sinacore DR, Klein S, Mittendorfer B. Fish oil-derived n-3 PUFA therapy increases muscle mass and function in healthy older adults. Am J Clin Nutr. 2015;102(1):115-22.
51. Hutchins-Wiese HL, Kleppinger A, Annis K, Liva E, Lammi-Keefe CJ, Durham HA, Kenny AM. The impact of supplemental n-3 long chain polyunsaturated fatty acids and dietary antioxidants on physical performance in postmenopausal women. The journal of nutrition, health & aging. 2013;17(1):76-80.
52. Rodacki CL, Rodacki AL, Pereira G, Naliwaiko K, Coelho I, Pequito D, Fernandes LC. Fish-oil supplementation enhances the effects of strength training in elderly women. Am J Clin Nutr. 2012;95(2):428-36.
53. Cornish SM, Chilibeck PD. Alpha-linolenic acid supplementation and resistance training in older adults. Applied physiology, nutrition, and metabolism = Physiologie appliquee, nutrition et metabolisme. 2009;34(1):49-59.
54. Brotto M. Aging, sarcopenia and store-operated calcium entry: a common link? Cell cycle (Georgetown, Tex). 2011;10(24):4201-2.
55. Dargelos E, Poussard S, Brulé C, Daury L, Cottin P. Calcium-dependent proteolytic system and muscle dysfunctions: a possible role of calpains in sarcopenia. Biochimie. 2008;90(2):359-68.
56. Petermann-Rocha F, Chen M, Gray SR, Ho FK, Pell JP, Celis-Morales C. Factors associated with sarcopenia: A cross-sectional analysis using UK Biobank. Maturitas. 2020;133:60-7.
57. Seo MH, Kim MK, Park SE, Rhee EJ, Park CY, Lee WY, Baek KH, Song KH, Kang MI, Oh KW. The association between daily calcium intake and sarcopenia in older, non-obese Korean adults: the fourth Korea National Health and Nutrition Examination Survey (KNHANES IV) 2009. Endocrine journal. 2013;60(5):679-86.
58. Ter Borg S, de Groot LC, Mijnarends DM, de Vries JH, Verlaan S, Meijboom S, Luiking YC, Schols JM. Differences in Nutrient Intake and Biochemical Nutrient Status Between Sarcopenic and Nonsarcopenic Older Adults-Results From the Maastricht Sarcopenia Study. Journal of the American Medical Directors Association. 2016;17(5):393-401.
59. Verlaan S, Aspray TJ, Bauer JM, Cederholm T, Hemsworth J, Hill TR, McPhee JS, Piasecki M, Seal C, Sieber CC, Ter Borg S, Wijers SL, Brandt K. Nutritional status, body composition, and quality of life in community-dwelling sarcopenic and non-sarcopenic older adults: A case-control study. Clin Nutr. 2017;36(1):267-74.
60. Ralapanawa DM, Jayawickreme KP, Ekanayake EM, Jayalath WA. B12 deficiency with neurological manifestations in the absence of anaemia. BMC research notes. 2015;8:458.
61. Behrouzi P, Grootswagers P, Keizer PLC, Smeets E, Feskens EJM, de Groot L, van Eeuwijk FA. Dietary Intakes of Vegetable Protein, Folate, and Vitamins B-6 and B-12 Are Partially Correlated with Physical Functioning of Dutch Older Adults Using Copula Graphical Models. The Journal of nutrition. 2020;150(3):634-43.
62. Ates Bulut E, Soysal P, Aydin AE, Dokuzlar O, Kocyigit SE, Isik AT. Vitamin B12 deficiency might be related to sarcopenia in older adults. Experimental gerontology. 2017;95:136-40.
63. Balboa-Castillo T, Struijk EA, Lopez-Garcia E, Banegas JR, Rodríguez-Artalejo F, Guallar-Castillon P. Low vitamin intake is associated with risk of frailty in older adults. Age Ageing. 2018;47(6):872-9.
64. Cesari M, Pahor M, Bartali B, Cherubini A, Penninx BW, Williams GR, Atkinson H, Martin A, Guralnik JM, Ferrucci L. Antioxidants and physical performance in elderly persons: the Invecchiare in Chianti (InCHIANTI) study. Am J Clin Nutr. 2004;79(2):289-94.
65. Bjørnsen T, Salvesen S, Berntsen S, Hetlelid KJ, Stea TH, Lohne-Seiler H, Rohde G, Haraldstad K, Raastad T, Køpp U, Haugeberg G, Mansoor MA, Bastani NE, Blomhoff R, Stølevik SB, Seynnes OR, Paulsen G. Vitamin C and E supplementation blunts increases in total lean body mass in elderly men after strength training. Scandinavian journal of medicine & science in sports. 2016;26(7):755-63.
66. Rogerson D. Vegan diets: practical advice for athletes and exercisers. Journal of the International Society of Sports Nutrition. 2017;14:36.
67. Craig WJ. Health effects of vegan diets. Am J Clin Nutr. 2009;89(5):1627s-33s.
68. Rosell MS, Lloyd-Wright Z, Appleby PN, Sanders TA, Allen NE, Key TJ. Long-chain n-3 polyunsaturated fatty acids in plasma in British meat-eating, vegetarian, and vegan men. Am J Clin Nutr. 2005;82(2):327-34.
69. Burdge GC, Calder PC. α-Linolenic acid metabolism in adult humans: the effects of gender and age on conversion to longer-chain polyunsaturated fatty acids. European Journal of Lipid Science and Technology. 2005;107(6):426-39.
70. Conquer JA, Holub BJ. Supplementation with an algae source of docosahexaenoic acid increases (n-3) fatty acid status and alters selected risk factors for heart disease in vegetarian subjects. The Journal of nutrition. 1996;126(12):3032-9.
71. https://www.myfooddata.com/articles/high-leucine-foods.php#leucine-foods-list
72. Hoge Gezondheidsraad. Voedingsaanbevelingen voor België - 2016. Brussel: HGR; 2016. Advies nr. 9285
73. van Vliet S, Fappi A, Reeds DN, Mittendorfer B. No independent or combined effects of vitamin D and conjugated linoleic acids on muscle protein synthesis in older adults: a randomized, double-blind, placebo-controlled clinical trial. Am J Clin Nutr. 2020 Aug 29;nqaa240. doi: 10.1093/ajcn/nqaa240. Online ahead of print.



